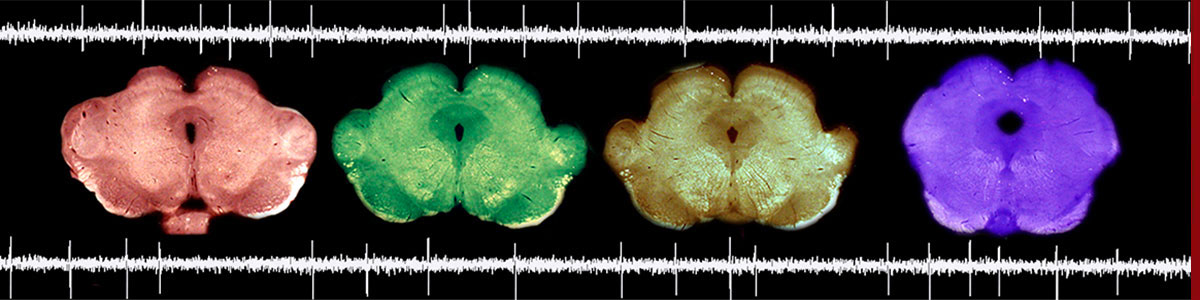
Signatures transcripionnelles et épigénétique des opiacés
Pierre-Eric LUTZ

Présentation
 Les opioïdes comme la morphine ou l’héroïne sont depuis des siècles une bénédiction aussi bien qu’une malédiction pour l’homme. Alors qu’ils restent les antalgiques les plus efficaces et les plus prescrits, leur utilisation prolongée peut conduire certains individus à développer un trouble de leur usage (ou addiction). Lorsqu’un tel trouble est constitué, les patients font face, parfois toute leur vie, au défi de contrôler la consommation de ces produits.
Les opioïdes comme la morphine ou l’héroïne sont depuis des siècles une bénédiction aussi bien qu’une malédiction pour l’homme. Alors qu’ils restent les antalgiques les plus efficaces et les plus prescrits, leur utilisation prolongée peut conduire certains individus à développer un trouble de leur usage (ou addiction). Lorsqu’un tel trouble est constitué, les patients font face, parfois toute leur vie, au défi de contrôler la consommation de ces produits.
Un défi majeur pour la recherche est de comprendre comment les opioïdes peuvent avoir des conséquences aussi prolongées et délétères sur le comportement des individus. Les travaux de notre équipe visent à aborder cette importante question clinique et sociétale, en explorant le rôle des mécanismes épigénétiques dans ces phénomènes. Ces mécanismes, comme la méthylation de l’ADN et les marques d’histones, correspondent à des modifications chimiques qui n’altèrent pas la séquence de l’ADN, mais modulent son organisation structurale et fonctionnelle. Alors qu’ils ont été principalement étudiés pour leur rôle dans la détermination de l’identité cellulaire (au cours du développement embryonnaire ou lors de processus cancéreux), des données récentes suggèrent qu’ils seraient particulièrement actifs dans les cellules neuronales post-mitotiques. Ils ont notamment été impliqués dans toute une série de maladies psychiatriques, comme la dépression et la schizophrénie.
Dans ce contexte, notre travail se concentre sur le rôle de la méthylation de l’ADN, une marque épigénétique majeure, dans les effets des opioïdes. Nous combinons pour cela des outils génétiques que nous développons chez la souris, avec des approches de séquençage de nouvelle génération et des modèles comportementaux. Notre objectif est de caractériser dans l’ensemble du génome les modifications de la méthylation de l’ADN, des marques d’histones et de l’expression des gènes qui se produisent lors d’un traitement opioïde chronique. Nous cherchons également à comprendre comment ces modifications moléculaires contribuent aux effets comportementaux de ces drogues, avec un intérêt particulier pour les effets aversifs du sevrage opioïde, et les conséquences émotionnelles négatives associées à l’abstinence prolongée.
Enfin, nous développons des approches expérimentales permettant d’analyser spécifiquement la sous-population neuronale exprimant le récepteur opioïde mu, qui est directement recrutée par les opioïdes. En effet, le tissu cérébral se compose d’une myriade de populations de cellules neuronales et gliales, qui chacune exprime un ensemble de gènes distincts sous le contrôle de processus épigénétiques particuliers. Face à cette complexité, nous espérons que la spécificité cellulaire de nos analyses permettra de révéler avec une précision nouvelle les adaptations épigénétiques subtiles qui contribuent aux effets délétères des opioïdes, et à l’addiction à ces substances.
Voir aussi: nos projets de recherche chez l’homme

Margot Diringer

Hanus Slavik

Yahia Hadj-Arab

Esther Colantonio
- Raoul Belzeaux, El Chérif Ibrahim, Eduardo Gascon (Institut de Neurosciences de la Timone, Marseille, France)
- Andrée Delahaye-Duriez (AP-HP, Neurodiderot Inserm UMR 1141, Paris, France)
- Bruno Etain, Cynthia Marie-Claire (Université Paris Descartes, INSERM UMR 1144, Paris, France)
- Laurence Lalanne, Emmanuel Darcq, Brigitte Kieffer (CRBS, INSERM U 1114, Strasbourg, France)
- Karine Merienne, Anne-Laurence Boutillier (LNCA, CNRS UMR 7364, Strasbourg, France)
- Anaïs Bardet (IGBMC, UMR 7104, Illkirch, France)
- Boris Chaumette (IPNP, INSERM U 1266, Paris, France)
- Gustavo Turecki (McGill Group for Suicide Studies, Douglas Hospital, McGill University, Montréal, Canada)
- Benoit Labonté (Institut CERVO, Université Laval, Québec, Canada)
- Amazigh Mokhtari, PhD (actuellement ingénieur en sciences des données, Sanofi)
- Ilona Bouvard, MSc (actuellement étudiante, Master Audiovisuel, journalisme et communication scientifiques, Paris)
- Modifications génétiques chez la souris (récepteurs opioïdes, enzymes épigénétiques)
- Génomique haut-débit (RNA-Seq, Enzymatic Methylation sequencing, RREMseq, EPIC arrays, ChIP-Seq, CUT&Tag)
- PCR quantitative, immunohistochimie, hybridation in situ
- Imagerie in vivo par photométrie de fibre (calcium, dopamine)
- Modélisation des réponses comportementales aux opioïdes: conditionnement aversif induit par le sevrage, préférence et aversion de place en temps réel, conséquences émotionnelles de l’abstinence, sensibilisation et tolérance psychomotrices
- Agence Nationale pour la Recherche (ANR)
- Institut pour la Recherche en Santé Publique / Institut National du Cancer (IReSP-INCa, AAP Addictions)
- Fondation Fyssen (subvention de recherche)
- Fondation de l’Avenir (recherche médicale appliquée)
- Université de Strasbourg (Idex Attractivité)
- Fondation pour la Recherche sur le Cerveau (FRC)
- Fondation pour la Recherche médicale (FRM équipe)
- American Foundation for Suicide Prevention (AFSP)