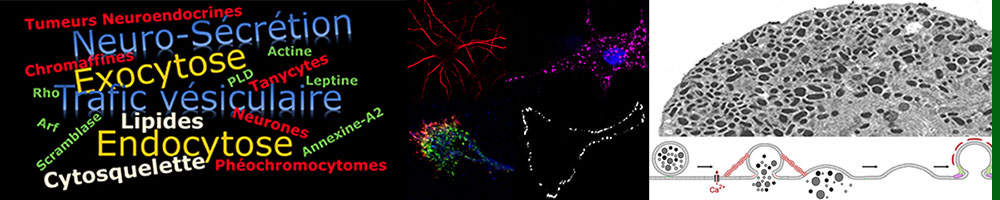
Trafic membranaire intracellulaire dans les systèmes nerveux et neuroendocrines
Stéphane GASMAN & Nicolas VITALE

Présentation
Le fonctionnement des systèmes nerveux et neuroendocrines repose sur la sécrétion de molécules informatives, un processus régulé par un intense trafic membranaire (exocytose, endocytose, transport vésiculaire). 
Le but de nos recherches est de décrypter les mécanismes moléculaires qui contrôlent ces différentes étapes de trafic et d’en révéler les altérations qui sont à la base de pathologies importantes (retard mental, maladies neurodégénératives, cancers neuroendocrines, obésité…).
En utilisant des neurones, des cellules neuroendocrines ou des cellules gliales, nous étudions plus particulièrement les mécanismes qui permettent à différents lipides et protéines de contrôler l’ensemble des étapes de la vie des vésicules, allant de la biogénèse jusqu’à la fusion membranaire, en passant par leur transport au sein des cellules.
> Formation des sites d’exocytose
Sylvette CHASSEROT-GOLAZ
> Sites de contact membranaire et exocytose régulée
Sylvette CHASSEROT-GOLAZ, Nicolas VITALE
> Sécrétions et tumeurs neuroendocrines
Stéphane GASMAN
> Transport des hormones métaboliques vers le cerveau
Stéphane ORY, Stéphane GASMAN
> V-ATPase et maturation vésiculaire
Nicolas VITALE

(doctorante)
Les maladies métaboliques, telles que l’obésité, sont aujourd’hui un problème de santé publique majeur et les mauvaises habitudes alimentaires, conduisant notamment à la consommation excessive d’acides gras saturés (AGS), apparaissent comme un des principaux facteurs de risque. Ces pathologies sont associées à une neuroinflammation dans plusieurs régions de l’hypothalamus incluant l’éminence médiane ainsi qu’à une perte de réponse à la leptine, une hormone anorexigène déclenchant le message de satiété. Après avoir montré que la leptine transite par les microglies de l’éminence médiane, mon projet consiste à identifier le rôle et les mécanismes de son transport par les microglies, mais aussi à comprendre si et comment les AGS entrainent une altération fonctionnelle de l’hormone. Pour répondre à ces questions, j’utilise des cultures primaires de microglies et de la leptine fluorescente pour identifier les compartiments intracellulaires empruntés par la leptine lors de son transit par différentes techniques d’imagerie. Mon objectif est de comprendre l’impact du transport de la leptine sur le profil inflammatoire induit par les microglies soumises, ou non, à un traitement d’AGS.

(doctorant)
Mon projet de thèse en lien avec la maladie d’Alzheimer et le diabète de type 2 se trouve à l’interface entre la chimie et la biologie, celui-ci est financé par le programme 80’ de la MITI du CNRS. Ces deux maladies impliquent une production excessive de peptides en mesure de s’auto-assembler sous forme de fibres associées à une certaine toxicité cellulaire. Il s’agit des peptides amyloïde-beta dans le cas d’Alzheimer et de l’amyline pour le diabète de type 2. En réalisant des études de cinétique de co-assemblage sur la formation de co-agrégats, j’étudie l’impact que peuvent exercer entre eux ces deux peptides. Des études structurales permettent par ailleurs d’observer et comparer les fibres formées. L’impact de ces co-agrégats sur des cultures organotypiques d’hippocampe de souris est évalué afin d’en étudier la toxicité par des approches immunocytochimique ainsi qu’en mesurant l’activité de réseaux neuronaux par MEA. Cette thèse visant à déterminer si l’amyline permet d’établir un lien entre ces deux pathologies est réalisée en co-direction entre le Laboratoire de Chimie de Coordination à Toulouse et l’INCI à Strasbourg.

(doctorant)
Le rôle des lipides, constituants majeurs des membranes cellulaires, dans la libération des neurotransmetteurs et des hormones reste encore mal compris, notamment à cause d’un manque d’outils performant. Mon travail se base sur l’utilisation d’outils optogénétiques et la « chimie click », pour d’une part diriger des enzymes du métabolisme lipidique dans un compartiment spécifique et d’autre part, introduire dans les membranes des lipides « cliquables » permettant d’y greffer divers groupements fonctionnels. En utilisant ces outils novateurs sur des cellules chromaffines bovines, combiné avec des approches de microscopie avancées ou de l’électrochimie, j’explore les rôles pléïotropiques des lipides dans la neurosécrétion avec une précision spatiale et temporelle inégalée.

(doctorante)
Les fibres moussues véhiculent différentes informations sensorielles et motrices vers le cortex cérébelleux sous la forme de bouffées de potentiels d’action émises à très hautes fréquence. Les terminaisons présynaptiques des fibres moussues sont capables de soutenir la libération de glutamate à ces fréquences extrêmes ce qui implique une organisation particulière de la machinerie présynaptique de la neurotransmission. Lors de ma thèse, je cherche à caractériser les relations structure-fonction de ces terminaisons présynaptiques en me focalisant sur le rôle du réseau d’actine et de ses modulateurs telles que les GTPases monomériques de la famille Rho. Pour cela, je combine des techniques de transfections ciblées des fibres moussue avec une approche histologique (immunohistochimie, microscopie par expansion, microscopie confocale) ou électrophysiologique.
Nos Publications