Système opioïde, nociception et douleur
Dominique MASSOTTE

Présentation
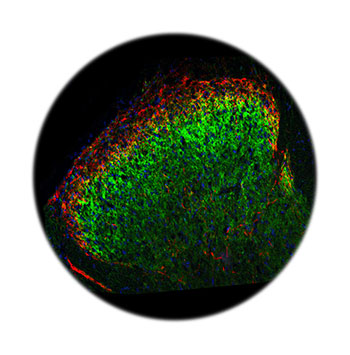 La douleur neuropathique touche 7 à 8 % de la population et représente un coût économique annuel de plusieurs milliards d’euros en Europe. Ce type de douleur est la conséquence directe d’une lésion ou d’une maladie affectant le système somatosensoriel. Les lésions des nerfs sensoriels, ainsi que les changements périphériques et centraux inadaptés dans les réseaux neuronaux qu’ils contactent, conduisent à l’apparition et au développement de la douleur neuropathique. La prévalence élevée de la douleur neuropathique en fait une priorité médicale qui reste très difficile à satisfaire en raison de la complexité des syndromes concernés et de l’absence de stratégies thérapeutiques efficaces. À ce jour, les traitements de première intention comprennent des antidépresseurs ou des anticonvulsivants qui ne sont que modérément efficaces et seulement dans 60 % des cas. Dans les autres cas, des opiacés ciblant les récepteurs opioïdes mu sont prescrits. Cependant, l’activation répétée de ces récepteurs induit des effets secondaires tels que la tolérance qui nécessite d’augmenter la dose pour maintenir l’effet analgésique. Pour améliorer l’efficacité de ces traitements, il est crucial d’identifier les altérations du contrôle opioïde endogène qui le rendent incapable de prévenir la douleur dans les conditions neuropathiques et qui contribuent à réduire l’efficacité des traitements médicamenteux. Les mécanismes conduisant à une réponse inadaptée du système opioïde endogène dans les conditions neuropathiques représentent donc des cibles thérapeutiques potentielles. Dans ce contexte, notre projet vise spécifiquement à identifier ces altérations afin de développer des stratégies thérapeutiques plus efficaces. En outre, étant donné la prévalence plus élevée de la douleur neuropathique chez les femmes, l’accent est également mis sur l’identification des différences liées au sexe dans ces mécanismes. Pour réaliser ces études, notre équipe allie modèle murin et analyses depuis les niveaux moléculaires et cellulaires jusqu’aux niveaux intégrés en combinant approches biochimiques, imagerie de fluorescence à haute résolution, cultures primaires, tranches de cerveau et de moelle épinière, électrophysiologie, spectrométrie de masse et comportement animal.
La douleur neuropathique touche 7 à 8 % de la population et représente un coût économique annuel de plusieurs milliards d’euros en Europe. Ce type de douleur est la conséquence directe d’une lésion ou d’une maladie affectant le système somatosensoriel. Les lésions des nerfs sensoriels, ainsi que les changements périphériques et centraux inadaptés dans les réseaux neuronaux qu’ils contactent, conduisent à l’apparition et au développement de la douleur neuropathique. La prévalence élevée de la douleur neuropathique en fait une priorité médicale qui reste très difficile à satisfaire en raison de la complexité des syndromes concernés et de l’absence de stratégies thérapeutiques efficaces. À ce jour, les traitements de première intention comprennent des antidépresseurs ou des anticonvulsivants qui ne sont que modérément efficaces et seulement dans 60 % des cas. Dans les autres cas, des opiacés ciblant les récepteurs opioïdes mu sont prescrits. Cependant, l’activation répétée de ces récepteurs induit des effets secondaires tels que la tolérance qui nécessite d’augmenter la dose pour maintenir l’effet analgésique. Pour améliorer l’efficacité de ces traitements, il est crucial d’identifier les altérations du contrôle opioïde endogène qui le rendent incapable de prévenir la douleur dans les conditions neuropathiques et qui contribuent à réduire l’efficacité des traitements médicamenteux. Les mécanismes conduisant à une réponse inadaptée du système opioïde endogène dans les conditions neuropathiques représentent donc des cibles thérapeutiques potentielles. Dans ce contexte, notre projet vise spécifiquement à identifier ces altérations afin de développer des stratégies thérapeutiques plus efficaces. En outre, étant donné la prévalence plus élevée de la douleur neuropathique chez les femmes, l’accent est également mis sur l’identification des différences liées au sexe dans ces mécanismes. Pour réaliser ces études, notre équipe allie modèle murin et analyses depuis les niveaux moléculaires et cellulaires jusqu’aux niveaux intégrés en combinant approches biochimiques, imagerie de fluorescence à haute résolution, cultures primaires, tranches de cerveau et de moelle épinière, électrophysiologie, spectrométrie de masse et comportement animal. 
Virginie Andry

Chantal Fitterer

Catherine Moreau

(doctorant)
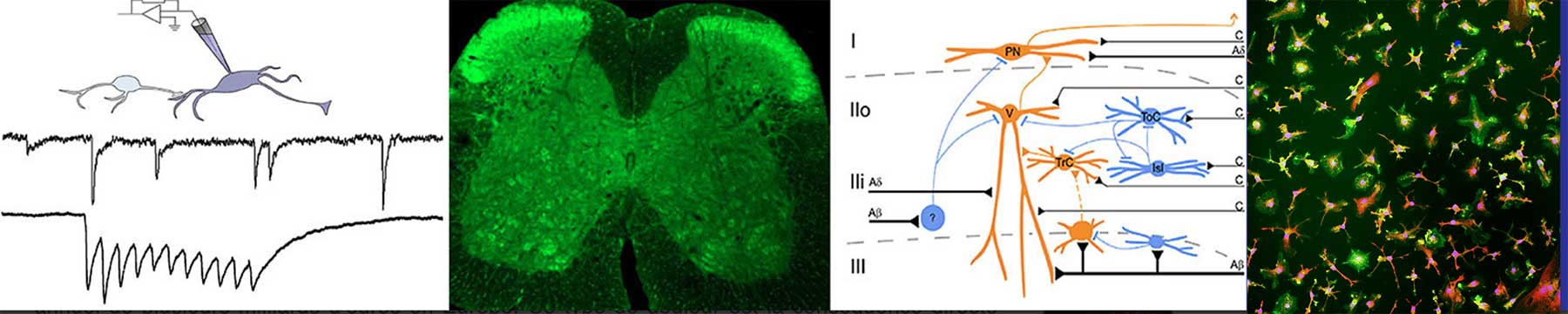
Les informations nociceptives, véhiculées depuis la périphérie par des fibres afférentes primaires, sont intégrées et traitées par un réseau d’interneurones de la corne dorsale de la moelle épinière. La balance excitation/inhibition dans ce réseau est essentielle pour moduler l’information nociceptive. La plasticité à court-terme des synapses inhibitrices de la lamina II, dans le cadre du traitement nociceptif, pourrait ajuster la sensibilité douloureuse. Grâce à des enregistrements électrophysiologiques sur tranches de moelle épinière, j’ai la possibilité de mettre en évidence cette plasticité des synapses inhibitrices selon la nature excitatrice ou inhibitrice des neurones postsynaptiques. Mon objectif est d’examiner si les seuils nociceptifs chez des souris mâles et femelles peuvent être corrélés à la balance excitation/inhibition de la lamina II et à son altération lors d’un état inflammatoire aigu.

(doctorant)
La neuropathie est associée à une neuro-inflammation qui conduit à une dérégulation du métabolisme. La morphine, utilisée pour soulager les douleurs neuropathiques, est moins analgésique comparée à son efficacité contre une douleur aiguë. Notre objectif est de comprendre si la neuropathie influence la dégradation de la morphine afin de développer de nouvelles stratégies permettant une analgésie efficace pour de telles douleurs.
Cathenaut L, Schlichter R & Hugel S. Short-term plasticity in the spinal nociceptive system. Pain (2023), 164: 2411-2424.
Cathenaut L, Leonardon B, Kuster R, Inquimbert P, Schlichter R & Hugel S. Inhibitory interneurons with differential plasticities at their connections tune excitatory/inhibitory balance in the spinal nociceptive system. Pain (2022). 163(5):e675-e688.
Gabel F, Hovhannisyan V, Andry V, Goumon Y. Central metabolism as a potential origin of sex differences in morphine antinociception but not induction of antinociceptive tolerance in mice. Br J Pharmacol. 2023 Apr;180(7):843-861. doi: 10.1111/bph.15792. Epub 2022 Feb 8. PMID: 34986502.
Gaborit M. and Massotte D. (2023) “Therapeutic potential of opioid receptor heteromers in chronic pain and associated comorbidities” The British Journal of Pharmacology 180(7), 994-1013.