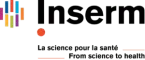Sexe, analgésique & métabolisme
Yannick GOUMON

Présentation
Deux projets distincts sont développés :
Etude de l’implication du métabolisme dans le dimorphisme sexuel observé pour les effets de la morphine : analgésie et tolérance.
La morphine reste l’antidouleur de choix pour le traitement des douleurs sévères et ce, malgré de nombreux effets secondaires incluant la tolérance analgésique et la dépression respiratoire.
Elle agit sur les récepteurs opioïdes Mu (MOR) qui sont exprimés par de nombreux neurones, des cellules gliales et des cellules immunitaires. Au sein du système nerveux central (SNC), et plus particulièrement au sein des circuits du contrôle de la douleur, la liaison de la morphine aux MORs inhibe le message nociceptif par le biais d’une hyperpolarisation neuronale.
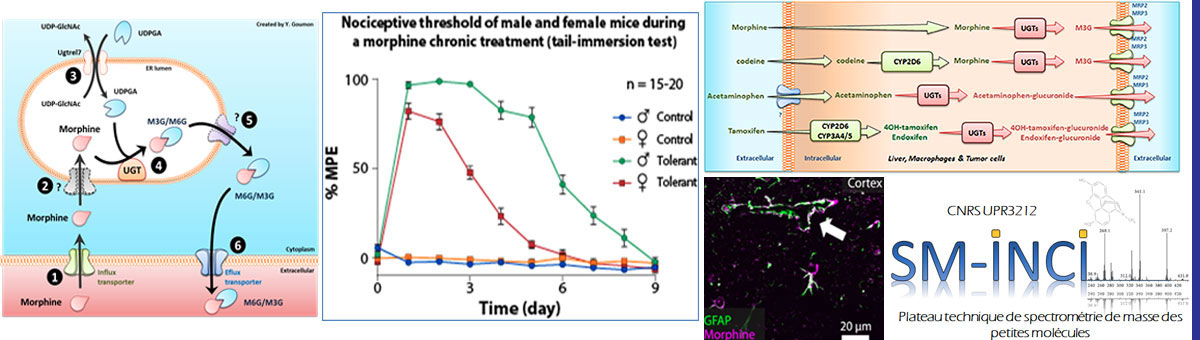
La morphine est principalement métabolisée en morphine-3-glucuronide par des UDP-glucuronosyl transférases (UGTs) exprimées dans le foie. Un métabolisme est également observé dans d’autres organes et le SNC. De manière intrigante, la M3G est décrite pour être pro-inflammatoire et pro-algique via un mécanisme qui est débattu.
Parmi les effets secondaires de la morphine, la tolérance à l’analgésie morphinique se caractérise par la diminution de l’effet analgésique au fil des administrations et ainsi, par le besoin d’augmenter les doses afin d’obtenir une analgésie suffisante. Différents mécanismes impliquant les récepteurs MORs ont été proposés pour expliquer son apparition (e.g., phosphorylation des MORs…). Cependant, à l’heure actuelle, aucune stratégie thérapeutique n’a permis de prévenir l’apparition de la tolérance analgésique ou de la contrecarrer.
De manière intéressante, chez les rongeurs, il existe un dimorphisme sexuel quant au pouvoir analgésique de la morphine et l’apparition de la tolérance. En effet, les femelles nécessitent plus de morphine pour atteindre une analgésie suffisante et deviennent tolérantes plus rapidement. Bien que les données existantes chez l’humain sont plus contrastées, ces différences liées aux sexes suggèrent des inégalités face à la prise en charge des douleurs en milieu hospitalier.
La mise en évidence des mécanismes sous-jacents à ce dimorphisme sexuel permettrait de comprendre l’apparition de la tolérance analgésique et de désigner de nouvelles stratégies visant à la prévenir ou à la guérir. D’autre part, notre but est de définir l’implication du métabolisme de la morphine (analgésie) en M3G (hyperalgésie) dans les différences liées au sexe observées dans l’analgésie induite par les morphiniques. La mise en évidence de l’importance de ces dimorphismes sexuels dans les circuits de contrôle de la douleur pourrait contribuer à la réflexion sur la prise en compte du sexe comme une variable pour le traitement de la douleur à l’hôpital.
Etude de l’impact des morphiniques et des antalgiques sur les traitements du cancer du sein.
En France, le cancer du sein est le cancer le plus fréquent chez la femme avec près de 55000 cas dépistés par an et 11000 décès. La majorité des cancers du sein sont dépendants des récepteurs aux œstrogènes (ER). Ainsi, les traitements anti-tumoraux ciblent soit les OR (e.g., le tamoxifène), soit la production d’œstrogènes (e.g., l’anastrozole). Après la chirurgie, ces traitements chroniques sont mis en place sur une période de 5 années.
Le tamoxifène et l’anastrozole sont métabolisés par des cytochromes et des UGTs, tout comme la morphine, la codéine et le paracétamol. Malheureusement, les patientes cancéreuses développent couramment (>50%, données IASP) des douleurs chroniques et neuropathiques consécutives à une chirurgie et/ou aux traitements anti-tumoraux (e.g., arthralgie). Ces douleurs sont traitées de manière chronique avec du paracétamol, de la codéine ou du paracétamol-codeiné. Or, leurs voies de dégradations communes avec ces anti-cancéreux suggèrent des interactions métaboliques qui pourraient être bénéfiques ou délétères.
Ce projet se base sur une étude pilote qui a démontré que la morphine possède un effet dramatique sur la dégradation du tamoxifène (Gabel & al. 2020, Front. Oncol.). Il vise à étudier l’impact du paracétamol et de la codéine sur le métabolisme du tamoxifène et de l’anastrozole. Le but est de déterminer quels analgésiques peuvent être utilisés chez les patientes traitées pour un cancer du sein afin d’éviter toutes interactions métaboliques, permettant ainsi une meilleure prise en charge des patientes. L’objectif est également d’établir si un co-traitement peut améliorer l’activité des agents anti-tumoraux et de développer de nouvelles stratégies thérapeutiques.
Approches techniques : comportement (test nociceptif), chirurgies, injection i.p., i.t., i.c.v., micro-dialyse, immunohistochimie (épi-fluorescence & confocal), culture cellulaire (lignées et cultures primaires), biochimie (Western blot, ELISA), spectrométrie de masse triple quad (méthode de dilution isotopique), électrophysiologie et imagerie calcique sur tranches de cerveau et culture cellulaire.
L’équipe héberge le plateau technique de spectrométrie de masse des peptites molécules de l’INCI (MS-INCI ; Dir. Technique V. Andry ; Dir. Scientifique Y. Goumon).