Sylvette CHASSEROT-GOLAZ, Nicolas VITALE

Présentation
 L’exocytose régulée est un processus complexe qui permet la libération de molécules informatives stockées au sein de vésicules dédiées afin de permettre la communication entre cellules dans des organismes pluricellulaires. Ce processus qui débute par la genèse des vésicules se poursuit par leur transport avant d’aboutir à leur arrimage à la membrane plasmique puis leur fusion en réponse à une élévation du calcium cytosolique permettant la libération de leur contenu à l’extérieur de la cellule et se termine par le recyclage des composants granulaire par endocytose compensatrice. De nombreuses protéines jouant un rôle clé dans ces processus ont été identifié au cours des dernières décennies. Bien que ce processus implique des compartiments membranaires spécifiques, le rôle des lipides, constituants majeurs des membranes et leur dynamique entre ces compartiments, restent bien moins compris.
L’exocytose régulée est un processus complexe qui permet la libération de molécules informatives stockées au sein de vésicules dédiées afin de permettre la communication entre cellules dans des organismes pluricellulaires. Ce processus qui débute par la genèse des vésicules se poursuit par leur transport avant d’aboutir à leur arrimage à la membrane plasmique puis leur fusion en réponse à une élévation du calcium cytosolique permettant la libération de leur contenu à l’extérieur de la cellule et se termine par le recyclage des composants granulaire par endocytose compensatrice. De nombreuses protéines jouant un rôle clé dans ces processus ont été identifié au cours des dernières décennies. Bien que ce processus implique des compartiments membranaires spécifiques, le rôle des lipides, constituants majeurs des membranes et leur dynamique entre ces compartiments, restent bien moins compris.
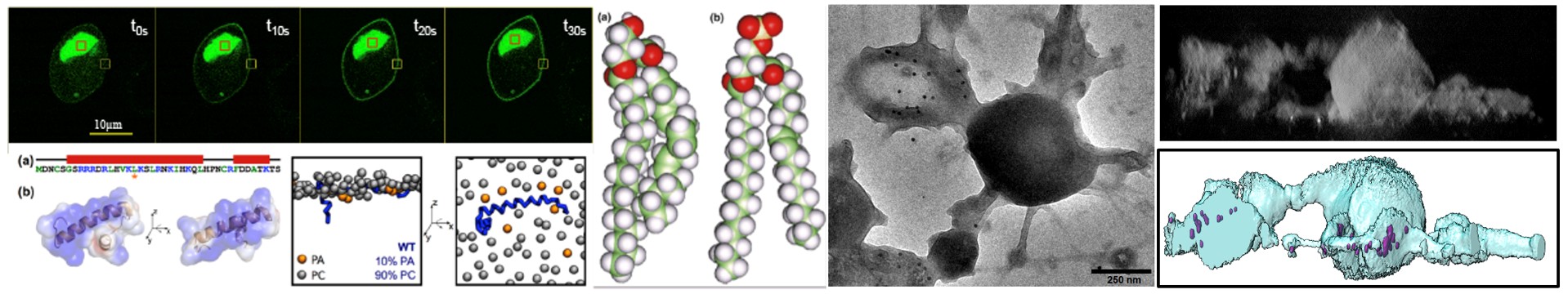
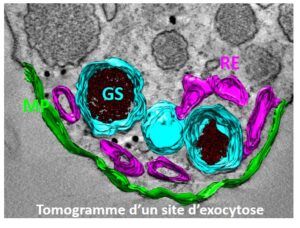
L’objectif de ce projet est de comprendre le rôle des sites de contact entre le réticulum endoplasmique, les granules de sécrétion et la membrane plasmique dans la régulation du cycle d’exocytose et d’endocytose. En particulier, nous étudions la dynamique du calcium à proximité des sites d’exocytose et la contribution des différentes formes d’acide phosphatidique (PA) au cours des différentes étapes de l’exocytose et leur dynamique au sein de ces sites de contact entre organelles.
Pour répondre à ces questions, nous utilisons une boite à outils moléculaires dédiée à l’étude du PA qui se base sur des approches optogénétiques et sur l’utilisation de nouvelles formes de PA de synthèse activable à la demande sur la base de la chimie click.
Pr Maité Montero : DC2N laboratory, Rouen
Pr Pierre-Yves Renard : CARMEN laboratory, Rouen
Dr Johann Böhm : IGBMC, Strasbourg
Dr Guillaume Drin : IPMC, Valbonne
Dr Oussama El Far : UNIS Laboratory, Marseille
Dr Franck Delavoie : University of Toulouse III, Toulouse
– Streit L, Delavoie F, Wolf A, Royer C, Haeberlé AM, Hugel S, Gasman S, Vitale N, Chasserot-Golaz S. Endoplasmic reticulum membrane contact sites coordinate exocytic site assembly and activity in neuroendocrine cells. BioRxiv 2026 https://doi.org/10.64898/2026.02.04.703764
– Schlichter A, Wolf A, Ferrand T, Cocq A, Riachy L, Vertueux S, Beauvais B, Courvalet M, Henry PJ, Tanguy E, Gonzales L, Ferlet R, Laguerre F, Decraene C, Pellissier A, Sebban M, Sabot C, Jeandel L, Cianférani S, Strub JM, Bénard M, Flon V, Peulon-Agasse V, Cardinael P, Ory S, Gasman S, Renard PY, Montero-Hadjadje M, Vitale N, Balieu S. Designing New Natural-Mimetic Phosphatidic Acid: A Versatile and Innovative Synthetic Strategy for Glycerophospholipid Research. Angew Chem Int Ed Engl 2025 Jul 8:e202510412.
– Tanguy E, Costé de Bagneaux P, Kassas N, Ammar MR, Wang Q, Haeberlé AM, Raherindratsara J, Fouillen L, Renard PY, Montero-Hadjadje M, Chasserot-Golaz S, Ory S, Gasman S, Bader MF and Vitale N. Mono- and poly-unsaturated phosphatidic acid regulate distinct steps of regulated exocytosis in neuroendocrine cells. Cell Reports 2020, 32(7):108026.
– Kassas N, Tanguy E, Thahouly T, Fouillen L, Heintz D, Chasserot-Golaz S, Bader MF, Grant NJ, Vitale N. Comparative characterization of phosphatidic acid sensors and their localization during frustrated phagocytosis. J Biol Chem 2017, 292: 4266-4279
– Gabel M, Delavoie F, Demais V, Royer C, Bailly Y, Vitale N, Bader MF, Chasserot-Golaz S. Annexin A2-dependent actin bundling promotes secretory granule docking to the plasma membrane and exocytosis.
J Cell Biol 2015 Aug 31;210(5):785-800
CNRS: Quand les lipides révèlent leurs secrets
Actualités INSERM: Le rôle de l’acide phosphatidique dans la sécrétion hormonale par les cellules neuroendocrines
Avanti Polar Lipids Research Spotlight: Mono- and Poly-unsaturated Phosphatidic Acid Regulates Distinct Steps of Regulated Exocytoses in Neuroendocrine Cells