Mécanismes neuroendocriniens impliqués dans la régulation des fonctions saisonnières
Valérie Simonneaux, Paul Klosen, Aurélia Ces, Vincent Joseph Poirel, Vebjorn Melum, Louise Sicot

Présentation
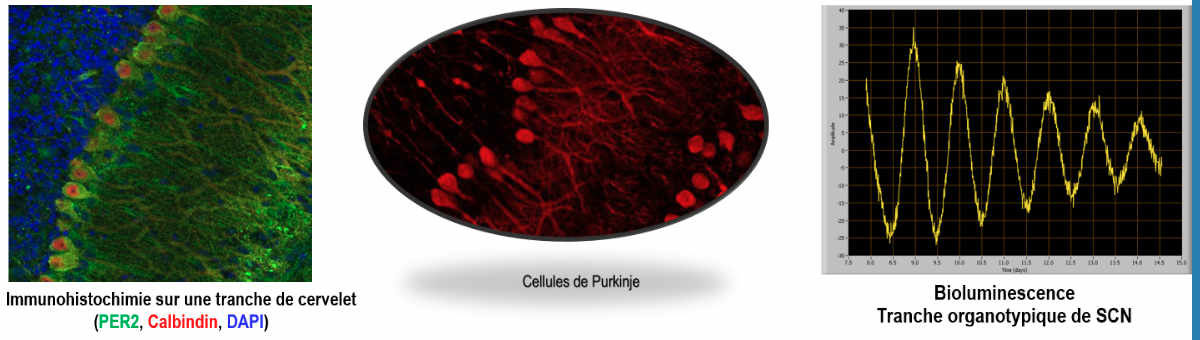
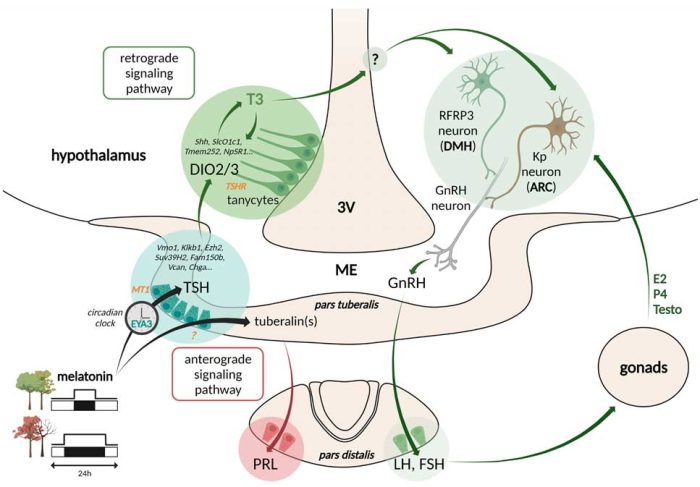
Le changement saisonnier de la sécrétion nocturne de l’hormone pinéale, la mélatonine, est traduit en une augmentation en été/longue photopériode de la synthèse de TSH (thyroid stimulating hormone) par la pars tuberalis de l’hypophyse. La TSH augmente à son tour la capacité des tanycytes (cellules gliales radiales situées dans la partie basale du 3ème ventricule) à convertir la T4 en T3 bioactive dans l’hypothalamus voisin (Dardente & Simonneaux, Front NeuroEndo, 2022 pour revue).
Notre objectif actuel est de tester l’hypothèse selon laquelle les tanycytes et des populations neuronales hypothalamiques spécifiques sont essentiels pour adapter les activités biologiques à long terme telles que la reproduction, le métabolisme, l’hibernation et la neurogliogenèse aux saisons.
Reproduction. Le peptide hypothalamique (Arg)(Phe) related peptide 3 (RFRP3), connu pour réguler l’activité des neurones GnRH, est fortement inhibé dans les conditions de jours courts/hiver chez tous les mammifères saisonniers. En collaboration avec le Dr H. Dardente (INRA, Nouzilly ; ANR GMO-Phen), nous testons l’hypothèse d’un rôle central des neurones RFRP3 dans l’adaptation saisonnière de la reproduction. Chez le hamster syrien et le mouton, nous développons la technologie Crispr-Cas9 pour évaluer l’effet du knock-out de RFRP3 sur la reproduction saisonnière, et nous comparons les changements photopériodiques dans le transcriptome des neurones RFRP3.
Hibernation. Les hamsters syriens maintenus dans une photopériode courte à basse température sont capables d’hiberner. Nous élucidons les voies neuroendocriniennes impliquées dans le déclenchement et l’arrêt des cycles d’hibernation en collaboration avec D. Hazlerigg et S. Wood de l’Université arctique de Tromso (Norvège ; financements INSB Diversity in Biological Mechanisms). Les données préliminaires montrent que la TSH, perfusée icv via des minipompes osmotiques programmables, empêche les épisodes d’hypothermie. De plus, dans des zones hypothalamiques spécifiques, des cellules qui restent à identifier sont activées à différents stades du cycle d’hibernation.
Programmation maternelle saisonnière. La mélatonine maternelle est capable de programmer le développement de la progéniture, puisque des hamsters nés d’une gestation maternelle sous photopériode longue ont un développement métabolique et reproductif plus rapide que les hamsters nés d’une gestation maternelle sous photopériode courte. En collaboration avec S. Wood et d. Hazlerigg de l’Université Arctique de Tromso (Norvège), nous étudions le rôle de la plasticité des tanycytes dans cette programmation maternelle saisonnière médiée par la mélatonine.
Neurogliogenèse saisonnière. L’adaptation saisonnière implique d’importants changements dans la plasticité des cellules hypothalamiques et l’expression des gènes. Le transfert en photopériode courte est associé à une augmentation de la neuro-gliogenèse hypothalamique. Nous étudions les signaux saisonniers régulant cette prolifération cellulaire induite par photopériode courte, le devenir des cellules prolifératives et le rôle putatif de ces nouvelles cellules hypothalamiques dans les fonctions saisonnières.
Melum VJ, Sáenz de Miera C, Markussen FAF, Cázarez-Márquez F, Jaeger C, Sandve SR, Simonneaux V, Hazlerigg DG, Wood SH. Hypothalamic tanycytes as mediators of maternally programmed seasonal plasticity. Curr Biol. 2024 :S0960-9822(23)01742-6. doi: 10.1016/j.cub.2023.12.042
Dardente H, Simonneaux V. GnRH and the photoperiodic control of seasonal reproduction: Delegating the task to kisspeptin and RFRP-3. J Neuroendocrinol. 2022 34(5):e13124. doi: 10.1111/jne.13124
Sáenz de Miera C, Bothorel B, Jaeger C, Simonneaux V, Hazlerigg D. Maternal photoperiod programs hypothalamic thyroid status via the fetal pituitary gland. Proc Natl Acad Sci U S A. 2017 ;114(31):8408-8413. doi:10.1073/pnas.1702943114
Henningsen JB, Ancel C, Mikkelsen JD, Gauer F, Simonneaux V. Roles of RFRP-3 in the Daily and Seasonal Regulation of Reproductive Activity in Female Syrian Hamsters. Endocrinology. 2017 ;158(3):652-663. doi: 10.1210/en.2016-1689
Sáenz de Miera C, Monecke S, Bartzen-Sprauer J, Laran-Chich MP, Pévet P, Hazlerigg DG, Simonneaux V. A circannual clock drives expression of genes central for seasonal reproduction. Curr Biol. 2014; 24(13):1500-6. doi: 10.1016/j.cub.2014.05.024
Klosen P, Sébert ME, Rasri K, Laran-Chich MP, Simonneaux V. TSH restores a summer phenotype in photoinhibited mammals via the RF-amides RFRP3 and kisspeptin. FASEB J. 2013 ;27(7):2677-86. doi: 10.1096/fj.13-229559
Ancel C, Bentsen AH, Sébert ME, Tena-Sempere M, Mikkelsen JD, Simonneaux V. Stimulatory effect of RFRP-3 on the gonadotrophic axis in the male Syrian hamster: the exception proves the rule. Endocrinology. 2012 Mar;153(3):1352-63. doi: 10.1210/en.2011-1622
Revel FG, Herwig A, Garidou ML, Dardente H, Menet JS, Masson-Pévet M, Simonneaux V, Saboureau M, Pévet P. The circadian clock stops ticking during deep hibernation in the European hamster. Proc Natl Acad Sci U S A. 2007 ;104(34):13816-20. doi: 10.1073/pnas.0704699104
Revel FG, Saboureau M, Masson-Pévet M, Pévet P, Mikkelsen JD, Simonneaux V. Kisspeptin mediates the photoperiodic control of reproduction in hamsters. Curr Biol. 2006 ;16(17):1730-5. doi: 10.1016/j.cub.2006.07.025